游朝慶
生物膜是電子顯微鏡下的結構,然而,在某些情況下,生物膜能沒有阻礙地生長,並經歷一段時間,此時,有可能生物膜可以長厚到能被肉眼看見,例如牙菌斑tooth plaque能在一天內長到能被看見。有些細菌在生物膜的型態下,會產生色素,如此也能有助於辨別生物膜,例如生物膜狀態下的綠膿桿菌Pseudomonas aeruginosa,其所發出『群聚感應』信號的綠膿菌色素Pyocyanin是綠色的29,然而,儘管如此,傷口中發現綠色染色也不一定是綠膿桿菌感染。 生物膜能和腐肉slough區分嗎?
傷口的腐肉slough通常被描述為在傷口床上面一層黏稠、黃色及不透明的膜層(圖2),而傷口上的生物膜也被描述為凝膠狀(gel-like)且帶有光澤的(shiny)30。圖2、right diabetic foot ulcer with slough
儘管如此,這兩者間應該還會有一些相關吧。生物膜會刺激組織導致發炎,增加血管通透性,導致傷口滲液量變多,因而形成了血纖維蛋白腐肉fibrin slough31,因此,腐肉可暗示著生物膜在傷口的存在,然而如此的關連仍然需要進一步的證實,而目前偵測生物膜最可靠的方法還是電子顯微鏡,如雷射掃描共軛焦顯微鏡(Laser Scanning Confocal Microscopy)。圖3是生物膜各時期的電子顯微鏡觀察照片。如此可知,生物膜在大多數狀況下是看不到的,但既然我們可以使用染料讓牙菌斑現形,在慢性傷口,為何沒有人想說做個特殊染料讓生物膜現形,以方便清創治療及證實生物膜的存在。(謎之音:請谷歌Biofilm Detection Kit – Realzyme)
圖3、細菌生物膜的形成過程。上圖是卡通示意圖,下圖則為該時期對應的電子顯微鏡觀察照片。 (圖片來源: http://mathbio.colorado.edu/mediawiki/index.php/MBW:Role_of_Biofilm_Matrix_in_Structural_Deve lopment,http://fun.nmns.edu.tw/files/userfiles/來偷聽細菌們的對話吧!.pdf)
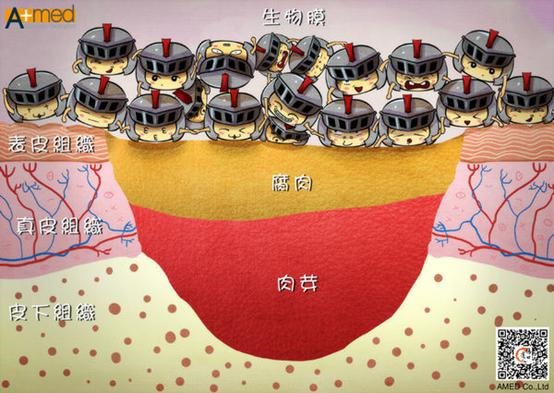
很多人喜歡用下面這個圖(圖4)來解釋slough就是巨大的biofilm,或者說slough的表面黏黏的,就是可抵抗外界壓力的biofilm,但這是不對的,biofilm是緊密附著於傷口表面(圖5),細菌的厚度大小約1微米(micrometers,µm,百萬分之一米),人類的細胞大小約10-100微米,而biofilm的總高度可達到10-30微米,最高可達100微米,雖然如此,也是和人類的細胞厚度差不多,也是肉眼看不到吧!而在biofilm外面還有一層對抗外界流速(剪力)的保護層稱為邊界層(hydrodynamic boundary layer),最外面也還有一層極厚的基礎液體層(bulk liquid)。但仍然沒有學說認為這基礎液體層就是slough,通常認為slough主要成分是蛋白質,大都是由宿主分泌組織液及富含蛋白質的壞死組織以及一部份脫離的細菌生物膜碎片組成,其很適合細菌生長,故容易形成biofilm,而不是biofilm去形成slough。因此『傷口達人』網站上的這張圖(圖6)是錯的。
圖4. biofilm (圖片來源: http://www.coe.montana.edu/biofilmbook/module_07/Mod07_S03_Blue.htm)
圖5.Biofilm的四層結構:地基substratum、生物膜biofilm、邊界層boundary layer及基礎液體層bulk liquid
(圖片來源:http://2011.igem.org/Team:ZJU-China/Biofilm)
圖6. Biofilm (圖片來源: http://amedwound2013.pixnet.net//blog/post/42155764-受傷的地方黃黃的,那個是甚麼呢?(下)
成熟的生物膜如何保護細菌
生物膜能使在其裡面的細菌增加對免疫系統、抗生素及缺乏營養及氧氣環境的耐受度32。方法有三:1.blocking封鎖,EPS保護細菌最簡單的方法就是避免大分子的抗體及免疫細胞穿透生物膜,而更成熟的生物膜甚至可以防止小分子的抗生素滲透進去33。2.Mutual protection聯盟或稱共同防禦,在多種細菌的生物膜內,不同的細菌會互相合作共同抵禦外侮,如有抗藥性的細菌會分泌保護因子來保護其周遭無抗藥性的細菌6。或者將其帶有抗藥密碼的基因與其他細菌交換34。有研究顯示綠膿桿菌形成的生物膜,可以使後來加入的大腸桿菌更容易存活及繁殖35。3.Hibernation休眠(quiescent bacteria處于靜止狀態的細菌),另一個策略就是讓在生物膜內的細菌冬眠6,36,37,細菌(bacteria)是一種具有細胞壁、細胞膜的生物,其生長繁殖需要合成蛋白質和核酸 (nucleic acid) (包括去氧核糖核酸DNA與核糖核酸RNA),而且透過代謝葉酸(folic acid)完成生理機能,抗生素可破壞這些結構與生化反應,達到對抗細菌的治療效果,但一旦細菌進入休眠停止生長,抗生素就對細菌無可奈何6,38。許多研究也證實說,需要抑制或殺死生物膜內細菌的最低抗生素濃度遠遠大於許多抗生素的最高允許劑量38-41,所以說一般標準的口服抗生素只能對浮游的細菌有效,但對於生物膜內的細菌可是完全無效。29. Dietrich LE, Price-Whelan A, Petersen A, et al. The phenazine pyocyanin is a terminal signalling factor in the quorum sensing network of Pseudomonas aeruginosa. Mol Microbiol 2006; 61(5): 1308-21.
30. Hurlow J, Bowler PG. Clinical experience with wound biofilm and management: a case series. Ostomy Wound Manage 2009; 55(4): 38-49.
31. Wolcott RD, Rhoads DD, Dowd SE. Biofilms and chronic wound inflammation. J Wound Care 2008; 17(8): 333-41.
32. Costerton JW, Lewandowski Z, Caldwell DE, et al. Microbial biofilms. Annu Rev Microbiol 1995; 49: 711-45.
33.Guiot E, Georges P, Brun A, et al. Heterogeneity of diffusion inside microbial biofilms determined by fluorescence correlation spectroscopy under two-photon excitation. Photochemistry and Photobiology 2002; 75(6): 570-79.
6.Hall-Stoodley L, Stoodley P. Evolving concepts in biofilm infections. Cell Microbiol 2009; 11(7): 1034-43.
34.Weigel LM, Donlan RM, Shin DH, et al. Highlevel vancomycin-resistant Staphylococcus aureus isolates associated with a polymicrobial biofilm. Antimicrob Agents Chemother 2007; 51(1): 231-38.
35. Liu Y, Li J. Role of Pseudomonas aeruginosa biofilm in the initial adhesion, growth and detachment of Escherichia coli in porous media. Environ Sci Technol 2008; 42(2): 443-49
36. Davies DG, Parsek MR, Pearson JP, et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science 1998; 280(5361): 295-98.
37. Lewis K. Persister cells, dormancy and infectious disease. Nat Rev Microbiol 2007; 5(1): 48-56.
38. Brooun A, Liu S, Lewis K. A doseresponse study of antibiotic resistance in Pseudomonas aeruginosa biofilms. Antimicrob Agents Chemother 2000; 44(3): 640-46
39. Koseoglu H, Aslan G, Esen N, et al. Ultrastructural stages of biofilm development of Escherichia coli on urethral catheters and effects of antibiotics on biofilm formation. Urology 2006; 68(5): 942-46.
40. Olson ME, Ceri H, Morck DW, et al. Biofilm bacteria: formation and comparative susceptibility to antibiotics. Can J Vet Res 2002; 66(2): 86-92.
41Conley J, Olson ME, Cook LS, et al. Biofilm formation by group a streptococci: is there a relationship with treatment failure? J Clin Microbiol 2003; 41(9): 4043-48.




沒有留言:
張貼留言